de Johannes Morstein y Kevan M. Shokat
Johannes Morstein Es becario postdoctoral NCI K99/R00 en el grupo del Dr. Shokat. Está trabajando para ampliar la capacidad de fármacos de las GTPasas y las interfaces proteína-membrana.
Kevan Shokat es profesor de la Universidad de California en San Francisco y líder en la búsqueda de nuevas terapias dirigidas. Desarrolló con éxito el primer inhibidor covalente de KRAS mutante (Sotorasib), que obtuvo la aprobación de la FDA en 2021 para el tratamiento de adultos con cáncer de pulmón de células no pequeñas (NSCLC) que portan la mutación KRAS G12C.
Actualmente, la mayoría de las moléculas de fármacos son monofuncionales. Esto significa que se unen a un único objetivo biológico, que puede ser un receptor, un transportador o una enzima (todos tipos diferentes de proteínas). Sin embargo, en los últimos años varios grupos de investigación han logrado desarrollar moléculas bifuncionales que se unen simultáneamente a dos objetivos biológicos diferentes. Hay muchas formas inteligentes de utilizar esta tecnología. Por ejemplo, puede acercar una proteína específica que causa enfermedades al proteasoma, que es el aparato de las células que recicla las proteínas. En otras palabras, estas moléculas bifuncionales pueden dar como resultado el reciclaje de una proteína elegida, lo que podría ser una vía atractiva en el descubrimiento de fármacos. En explicit, cuando un fármaco no es lo suficientemente potente por sí solo para inhibir completamente (es decir, inactivar) una proteína que causa la enfermedad, el reciclaje puede ser una solución y proporcionar un enfoque más eficaz que conduzca a la eliminación de la proteína que causa la enfermedad. de las células.
Hasta ahora en este campo, los esfuerzos para diseñar moléculas bifuncionales se han centrado principalmente en diseñar agentes que se unan simultáneamente a dos proteínas. En nuestro estudio, nos dimos cuenta de que la interacción entre proteínas y membranas también es muy importante para la mayoría de los procesos celulares. Por ejemplo, para que una célula detecte pistas del entorno (p. ej., una hormona, un issue de crecimiento, un estimulante), las señales deben transmitirse desde el espacio extracelular al espacio intracelular a través de su límite exterior, la membrana celular. En consecuencia, planteamos la hipótesis de que el desarrollo de un enfoque bifuncional para modular estas interacciones proteína-membrana podría generar otra vía atractiva en el desarrollo de fármacos.
En el cáncer, las células enfermas a menudo crecen sin management a través de una sobreestimulación constante de la señalización del crecimiento. Esto puede ocurrir cuando las proteínas típicamente involucradas en las cascadas de detección normales albergan mutaciones que conducen a su activación constante incluso en ausencia de estimulantes extracelulares. Lo más famoso es que las mutaciones en el oncogén KRAS pueden tener esta consecuencia. De hecho, KRAS es el oncogén humano que muta con mayor frecuencia, lo que significa que es el gen asociado con el impulso del crecimiento de muchos cánceres. Las mutaciones de KRAS son particularmente comunes en el cáncer de páncreas, el cáncer de pulmón y el cáncer colorrectal. A diferencia de muchas otras proteínas, Ok-Ras, la proteína que es producto del oncogén KRAS, resultó ser particularmente difícil de tratar y, durante mucho tiempo, se consideró «no farmacológica». Afortunadamente, esto ha cambiado y estamos presenciando las primeras aprobaciones de inhibidores de Ok-Ras por parte de la FDA y un número cada vez mayor de ensayos clínicos.
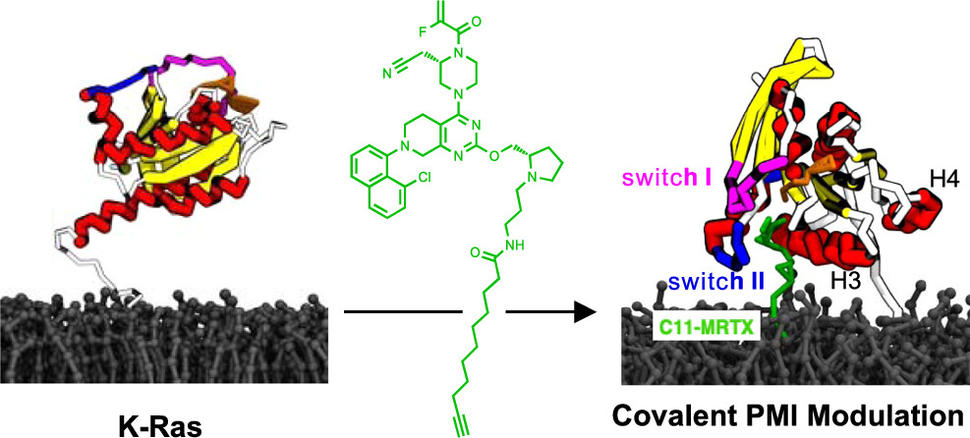
Una característica crítica de Ok-Ras es su débil asociación con la valva interna de la membrana plasmática. Para reformular esto en términos espaciales, Ok-Ras se encuentra en el sitio inside del límite exterior de las células. Esta ubicación y su asociación con la membrana plasmática son necesarias para su función. Si Ok-Ras no se encuentra allí, no funciona y no contribuye al crecimiento celular. Por lo tanto, en el estudio precise, pensamos en explorar un nuevo enfoque bifuncional al abordar estas interacciones directamente. Para ello, diseñamos moléculas que pueden unirse tanto a Ok-Ras como a la membrana. En una colaboración entre UCSF, el Laboratorio Nacional Frederick, el Laboratorio Nacional de Los Alamos y UTHealth Houston, pudimos demostrar que estas moléculas se unen tanto a Ok-Ras como a la membrana y, como resultado, cambian significativamente la forma en que ambos interactúan. .
Nuestras moléculas bifuncionales pegan Ok-Ras a la membrana en un lugar donde Ok-Ras generalmente no interactúa con la membrana. Pegar Ok-Ras a la membrana en una nueva posición también conduce a interacciones más estrechas, lo que restringe dos aspectos que son críticos para la función de Ok-Ras: su movilidad dinámica en la membrana y su agrupación con otras moléculas de Ok-Ras. Nuestro estudio fue la primera demostración de una molécula bifuncional diseñada específicamente para apuntar y modular las interacciones entre una proteína y una membrana. Nuestro enfoque podría ser útil para estudiar el papel de las interacciones proteína-membrana y agregar una nueva modalidad en el descubrimiento de fármacos que ayuda a atacar y, en última instancia, detener los impulsores del cáncer.