de Jesse Boumelha, Edurne Mugarza, Sophie de Carné Trécesson, Febe van Maldegem, Miriam Molina y Julian Downward Francis Crick Institute, Londres
Jesse Boumelha Trabaja en el laboratorio de Julian Downward en el Instituto Francis Crick, donde recientemente obtuvo su doctorado. Su investigación se centra en comprender los mecanismos de evasión inmune en nuevos modelos de ratón de cáncer de pulmón con mutación KRAS para desarrollar combinaciones racionales de inmunoterapia.
Edurne Mugarza es un ex estudiante de posgrado en el laboratorio Downward del Instituto Francis Crick que trabaja en inhibidores de KRAS-G12C y su influencia en el microambiente tumoral y la inmunidad antitumoral. Actualmente es investigadora postdoctoral en UCLA con Cristina Puig Saus.
Sophie de Carné Trécesson es un postdoctorado en el laboratorio Downward del Instituto Francis Crick, donde su trabajo se centra en cómo la señalización KRAS da forma al microambiente tumoral utilizando tecnologías unicelulares.
Febe van Maldegem Realizó un postdoctorado en Downward en el Instituto Francis Crick hasta el año pasado y ahora dirige su propio laboratorio en el Departamento de Inmunología y Biología Celular Molecular del Centro Médico de la Universidad de Ámsterdam. Trabaja en la investigación de las interacciones entre el tumor y el sistema inmunológico en el cáncer de pulmón, con énfasis en la organización espacial del microambiente tumoral.
Miriam Molina Arcas es científico investigador principal de laboratorio en el laboratorio Downward del Instituto Francis Crick. Su investigación gira en torno a la identificación de estrategias terapéuticas para el tratamiento de tumores de cáncer de pulmón que albergan mutaciones de KRAS.
Julián hacia abajoLa investigación de ‘s se ha centrado en los oncogenes RAS durante muchos años, primero en Most cancers Analysis UK y durante los últimos seis años en el Instituto Francis Crick de Londres. Su ambición es comprender completamente la interacción entre los cánceres con mutaciones de RAS y el sistema inmunológico y utilizar este conocimiento para curar cánceres avanzados mediante combinaciones de fármacos inhibidores de KRAS y terapias dirigidas al sistema inmunológico.
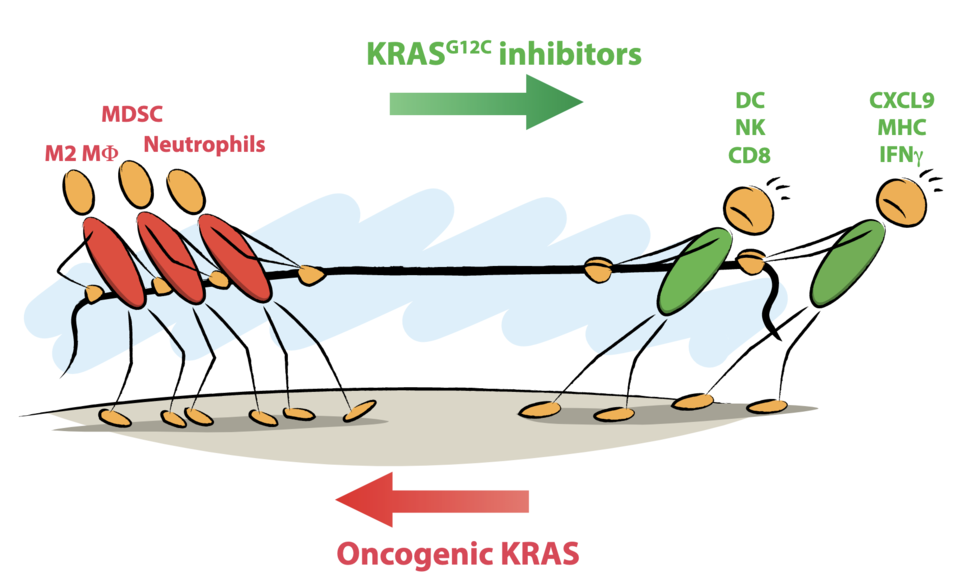
Han pasado 40 años desde el descubrimiento basic de los oncogenes RAS, que inició una nueva period de la biología del cáncer que definió la tumorigénesis como una enfermedad genética que implica la desregulación de los procesos celulares normales. Esto condujo a un rápido avance en nuestra comprensión de los mecanismos moleculares subyacentes a la tumorigénesis, en gran parte mediante el uso de modelos de ratón genéticamente modificados (GEMM), solidificando el papel causal de las mutaciones oncogénicas como impulsoras del fenotipo maligno. La mayoría de estos estudios se centraron en la contribución celular autónoma de los oncogenes a la proliferación, supervivencia y metabolismo celular. Sin embargo, la evidencia acumulada sugiere que la señalización oncogénica puede involucrar a las células huésped dentro del microambiente tumoral (TME) y amortiguar las respuestas inmunes que, dado el éxito clínico de la inmunoterapia, se ha reconocido que tienen poderosas funciones antitumorales. Sin embargo, los efectos del KRAS oncogénico sobre el TME han sido difíciles de estudiar debido a la falta de herramientas adecuadas. El trabajo pionero dirigido por Kevin Shokat durante los últimos 10 años ha dado como resultado el notable desarrollo de KRAS específico para mutantes.G12C inhibidores que inhiben directamente KRAS, hasta ahora considerado «no farmacológico», uniéndose al grupo tiol del nuevo residuo de cisteína, atrapándolo en un estado inactivo. Si bien un fármaco de este tipo tenía implicaciones clínicas masivas, también podría usarse como una herramienta preclínica para inhibir específicamente la señalización oncogénica de KRAS en células tumorales para investigar la influencia de la señalización oncogénica intrínseca de las células tumorales en el TME.
Uso de múltiples modelos de ratón inmunocompetentes de KRASG12C-cáncer de pulmón mutante, investigamos el efecto de KRASG12C inhibición de la TME e inmunidad antitumoral (1). Este trabajo demostró que la señalización oncogénica de KRAS promueve la inmunosupresión a través de múltiples mecanismos, incluido el impulso de la expresión de quimioatrayentes de células mieloides, la inhibición de la presentación de antígenos y la inhibición directa de la señalización del interferón intrínseco tumoral (IFN), que es basic para la inmunidad antitumoral. Es importante destacar que KRASG12C la inhibición revirtió la inmunosupresión mediada por KRAS, remodelando el TME con una infiltración reducida de monocitos y neutrófilos acompañada por una afluencia de células T con funciones citotóxicas mejoradas. Además, la muerte de las células tumorales promovida por KRASG12C la inhibición promovió la captación de antígenos y la secreción de quimioatrayentes de células T por parte de las células dendríticas.
El desarrollo histórico de KRASG12C Los inhibidores han sido seguidos rápidamente por la generación de compuestos clínicos, que han demostrado una eficacia prometedora en ensayos clínicos en fase inicial. El sotorasib (AMG-510) de Amgen fue aprobado recientemente por la FDA para el tratamiento del KRAS localmente avanzado o metastásico.G12C NSCLC. Si bien sotorasib logra un management tumoral impresionante en una proporción sustancial de pacientes, los beneficios suelen ser de corta duración debido a la rápida adquisición de resistencia. De hecho, un reciente ensayo clínico de fase III que comparó sotorasib con docetaxel demostró que, si bien KRASG12C Aunque la inhibición mejoró la supervivencia libre de progresión, no logró extender la supervivencia common de los pacientes. Este es un problema compartido con muchas otras terapias dirigidas y contrasta marcadamente con las respuestas duraderas logradas en un subconjunto de pacientes tras la revitalización de la inmunidad antitumoral mediante inmunoterapia. Por lo tanto, una mayor comprensión de cómo los inhibidores de KRAS afectan el TME y la inmunidad antitumoral será essential para desarrollar estrategias racionales de combinación terapéutica.
Obtener conocimientos clínicamente significativos requiere el uso de modelos preclínicos de ratón que reflejen la variedad de paisajes inmunológicos observados en el cáncer de pulmón humano. La EMT en el cáncer humano se puede clasificar en tres fenotipos principales: inmunodesértico (‘frío’), inmunoexcluido e ‘inflamado’ (2). Los tumores inflamados están infiltrados por numerosas células inmunitarias, incluidas las células T citotóxicas, y es más possible que respondan a la inmunoterapia mientras están inmunes excluidos, donde las células inmunitarias están confinadas al estroma, y los tumores «fríos», que contienen pocas células T, normalmente son resistentes a inmunoterapia. Los modelos preclínicos de cáncer de pulmón en ratones son notoriamente poco inmunogénicos, muestran TME «fríos» o inmunoexcluidos y son refractarios a la inmunoterapia. Dado que el 20% de los pacientes con cáncer de pulmón responden a la inmunoterapia, generamos un nuevo modelo de ratón inmunogénico de cáncer de pulmón con mutación KRAS (3) mediante el establecimiento de líneas celulares a partir de tumores KP autóctonos que expresan la citosina desaminasa del ADN humano APOBEC3B para aumentar la carga mutacional que es notoriamente baja en los tumores GEMM. El modelo ortotópico resultante estimuló respuestas inmunitarias antitumorales espontáneas y fue parcialmente wise a la inmunoterapia, aunque, sorprendentemente, las respuestas inmunitarias se dirigieron a antígenos retrovirales endógenos en lugar de neoantígenos inducidos por APOBEC3B. Este modelo ha demostrado ser muy útil para el estudio de procesos que regulan la inmunidad antitumoral y la evaluación de combinaciones de inmunoterapia y dirigidas.
Utilizando modelos de ratón con diferentes paisajes inmunológicos, demostramos que KRASG12C la inhibición revirtió la inmunosupresión, induciendo un programa transcripcional proinflamatorio y estimulando la inmunidad adaptativa en tumores de pulmón «fríos», inmunoexcluidos e «inflamados». Esto nos llevó a evaluar la sinergia potencial de KRAS.G12C inhibición e inmunoterapia que ya ha demostrado una eficacia superior en un modelo preclínico de cáncer colorrectal. Sin embargo, esta combinación sólo resultó beneficiosa en el modelo de cáncer de pulmón «inflamado», y un subconjunto sustancial de ratones logró respuestas duraderas. De manera comparable, demostramos que la inmunidad adaptativa contribuyó a respuestas duraderas en ratones tratados con KRAS.G12C inhibidores pero, de nuevo, sólo en tumores «inflamados». Estos hallazgos tienen marcadas implicaciones clínicas, ya que sugieren que la combinación de KRASG12C Los inhibidores con inmunoterapia sólo pueden beneficiar a los pacientes con tumores «inflamados». La mayoría de los ensayos clínicos que prueban esta combinación, con la excepción de KRYSTAL-7, incluyen principalmente a pacientes que han progresado con la inmunoterapia y, por lo tanto, es posible que no se obtengan beneficios potenciales. Es posible que se requieran estrategias de combinación adicionales para sensibilizar los tipos de tumores «fríos» a la inmunoterapia y serán esenciales estudios futuros que utilicen modelos preclínicos de cáncer de pulmón que cubran la variedad de paisajes inmunológicos observados en humanos para descubrirlos.
Si bien estos estudios preclínicos han arrojado luz sobre la utilidad potencial de combinar KRASG12C inhibidores con inmunoterapia en un subconjunto de pacientes con cáncer de pulmón, existe un problema más inmediato que debe superarse. El ensayo clínico de fase inicial de Amgen que combina sotorasib con inmunoterapia se vio obstaculizado por toxicidades hepáticas de alto grado en una proporción sustancial de pacientes. La fuente de estas toxicidades aún no está clara, pero puede estar relacionada con la dosis excesiva a la que se administra sotorasib, inicialmente considerada tolerable debido a la naturaleza mutante específica del fármaco. Una pregunta clave es si los modelos preclínicos serán útiles para estudiar los mecanismos subyacentes a las toxicidades que surgen de estas terapias combinadas. De hecho, los eventos adversos relacionados con el sistema inmunológico que son comunes en pacientes tratados con inmunoterapia rara vez se observan en modelos preclínicos de ratón. Más allá de esto, una mayor comprensión de cómo el KRAS oncogénico promueve la inmunosupresión, especialmente teniendo en cuenta los avances recientes en las tecnologías unicelulares, podría identificar nuevas estrategias de combinación inmunitaria que podrían mejorar los resultados de los pacientes con cáncer de pulmón con mutación de KRAS.